Borrelia burgdorferi sensu stricto (B31) CRASP-1 Protein, 100ug
R$12.934,55
Proteína CRASP-1 de Borrelia burgdorferi recombinante fundida à marca MBP e produzida em E. coli.
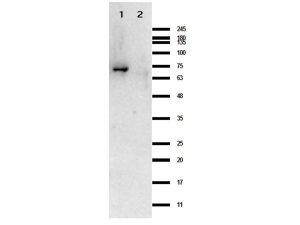
Western blot results of Rabbit Anti-CRASP-1 Antibody. Lane 1: CRASP-1 protein. Lane 2: MBP. Load: 0.05 µL. Primary Antibody: Rabbit Anti-CRASP-1 Antibody at 1.0mg/mL overnight at 4°C. Secondary Antibody: Goat anti-Rabbit at 1:70,000 for 30 min at RT. HiGlo Blocking Buffer for 30min at room temperature. Expect: ~63.9kDa.
Disponível por encomenda
PROTEÍNA BORRELIA BURGDORFERI SENSU STRICTO (B31) CRASP-1
Proteína CRASP-1 de Borrelia burgdorferi recombinante, fundida a uma marca MBP e produzida em E. coli (>90% de pureza).
DETALHES DO PRODUTO – BORRELIA BURGDORFERI SENSU STRICTO (B31) PROTEÍNA CRASP-1
- Proteína CRASP-1 de Borrelia burgdorferi recombinante (número de acesso ao NCBI: NP_045741).
- Maior que 90% puro (por SDS-PAGE) em 0,02 M de Fosfato de Potássio, 0,15 M de Cloreto de Sódio, pH 7,2 e 0,01% (p/v)
de Azida de Sódio.
FUNDO
A Proteína de Superfície Constituinte do Complemento 1 (CRASP-1, CspA) é uma proteína multifuncional de 25,9 kDa, codificada pela espiroqueta B. burgdorferi, que é transportada por carrapatos Ixodes. A cepa B31 é a cepa tipo (ATCC 35210) para este organismo e foi derivada por clonagem dilucional limitada do isolado original do carrapato da doença de Lyme obtido por A. Barbour (Johnson, et al., 1984). O CRASP-1 nativo representa um homodímero com uma dobra de proteína complexa anteriormente desconhecida (Cordes, et al., 2005).
O CRASP-1 e quatro proteínas adicionais de evasão imunológica se ligam a combinações de reguladores plasmáticos humanos, incluindo colágeno I, colágeno III, colágeno IV, fibronectina, laminina, proteína semelhante ao fator H 1 (FHL-1) (resultando na inibição da ativação do complemento em mamíferos) e proteína morfogênica óssea humana 2. Essas interações podem contribuir para a adesão, colonização bacteriana e tropismo de órgãos para promover a disseminação de B. burgdorferi no hospedeiro.
As espécies de Borrelia contêm um grande número de plasmídeos lineares e circulares, alguns dos quais parecem ser repetidos ou contêm fragmentos de outros genes. Essas regiões podem servir como pools de variabilidade para a sobrevivência de Borrelia em seus múltiplos ambientes durante seu ciclo de vida. Múltiplas cópias de sequências análogas aos genes CRASP-1 foram detectadas em plasmídeos de Borrelia. Além disso, a sequência para CRASP-1 contém uma sequência repetida dobrada em uma estrutura de alça de haste estável, típica de genes de RNA (Kraiczy, et al., 2004).
O CRASP-1 também se liga aos componentes C7 e C9 do complemento terminal humano e bloqueia a montagem e inserção por membrana do complexo do complemento terminal (TCC), conforme confirmado por ensaios hemolíticos, inibindo a polimerização de C9. Quando o CRASP-1 foi expresso ectopicamente na superfície de B. garinii sensível ao soro, ele bloqueou a montagem do TCC e induziu resistência sérica nas bactérias transformadas. Ao induzir a resistência sérica e a inibição da via terminal do complemento, B. burgdorferi é capaz de sobreviver no ambiente hostil do plasma humano (Hallström, et al., 2010).
REFERÊNCIAS
- Cordes, F. S. et al., 2005. Uma nova dobra para a proteína de ligação ao fator H BbCRASP-1 de Borrelia burgdorferi. Nat struct mol biol. , Volume 3, pp. 276-7.
- Hallström, T. et al., 2010. • A proteína de superfície 1 de Borrelia burgdorferi que adquire o regulador do complemento liga-se à proteína morfogênica óssea humana 2, a várias proteínas da matriz extracelular e ao plasminogênio. J Infect Dis., 202(3), pp. 490-8.
- Johnson, R.C., et al. 1984. Nov.: agente etiológico da doença de Lyme. Int J Syst Bacteriol, 34, pp. 496–497.
- Kraiczy, P. et al., 2004. A resistência ao complemento de Borrelia burgdorferi se correlaciona com a expressão de BbCRASP-1, uma nova proteína de superfície codificada por plasmídeo linear que interage com o fator H humano e FHL-1 e não está relacionada às proteínas Erp. J Biol Chem., 279(4), pp. 2421-9.
Produtos relacionados
-
R$6.286,18Adicionar ao carrinho
O anticorpo anti HIV-1 p24 (clone 1947) de camundongo foi desenvolvido para uso em ELISA e IFA.
-
R$6.286,18Adicionar ao carrinho
Anticorpo monoclonal de camundongo contra a proteína NS1 do vírus da dengue. O anticorpo é específico para o sorotipo 1 do vírus da dengue e é adequado para aplicações ELISA e Western blot.
Ficha técnica do produto:
Ficha de segurança:
-
R$6.286,18Adicionar ao carrinho
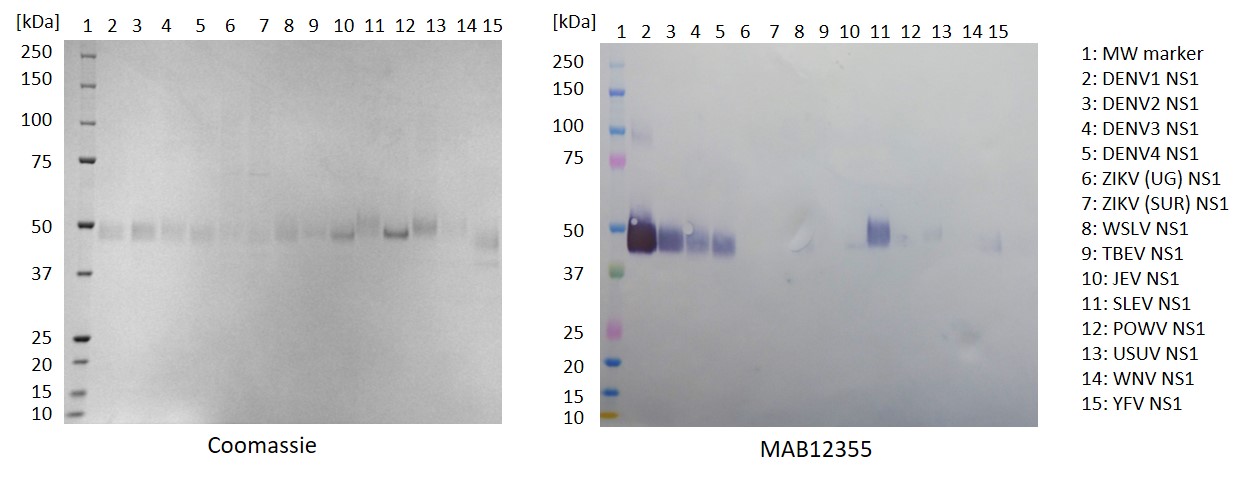
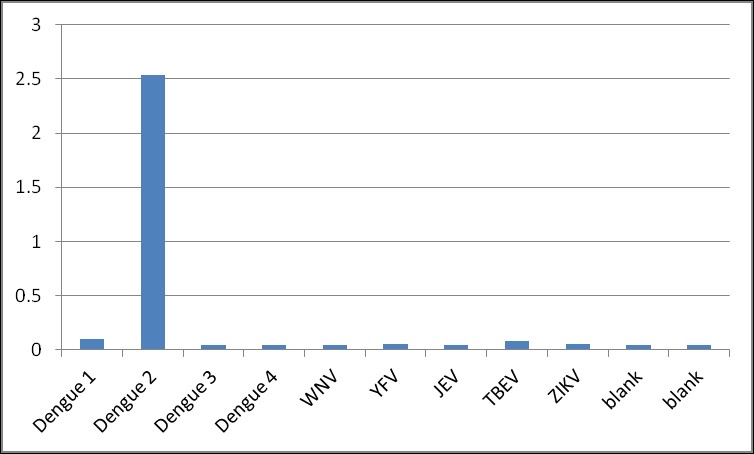
Anticorpo monoclonal de camundongo específico para o vírus da dengue sorotipo 2 NS1 (clone LH5), sem reatividade cruzada com proteínas NS1 de outros sorotipos do vírus da dengue ou outros flavivírus. Adequado para uso como anticorpo de par combinado para detecção específica do sorotipo NS1.
Ficha técnica do produto:
Ficha de segurança:
-
R$8.439,77Adicionar ao carrinho
O anticorpo anti-proteína Envelope de Flavivírus de coelho (4G2) é um anticorpo quimérico de coelho feito usando as sequências de domínio variável do anticorpo 4G2 de camundongo. Ele reconhece antígenos específicos do grupo de flavivírus, incluindo vírus da dengue, vírus do Nilo Ocidental, encefalite japonesa, vírus da febre amarela, vírus Zika etc. e se liga ao loop de fusão na extremidade do domínio II da proteína E.