Worthington
Showing all 48 results
-
R$4.696,16Adicionar ao carrinho
A albumina sérica bovina consiste em nove alças conectadas por 17 pontes dissulfeto que são protegidas no núcleo da proteína (Restani et al. 2004). A albumina sérica bovina é muito solúvel em água, mas é relativamente resistente à digestão.
Número de Acesso à Proteína: P02769
Classificação CATH (v. 3.2.0):
- Classe: Principalmente Alfa
- Arquitetura: Pacote Ortogonal
- Topologia: Albumina Sérica; Cadeia A, Domínio 1
(Com base na albumina sérica humana, que é 76% idêntica à bovina)
Peso molecular:
- 66,4 kDa (Teórico)
Faixa de pH ideal: 5,0-7,0 (El Kadi et al. 2006)
Ponto de isolação eletrica:
- 5,60 (Teórico)
Coeficiente de extinção:
- 41.180 cm -1 M -1 (Teórico)
- E 1%,280 = 6,20 (Teórico)
-
R$1.677,20Adicionar ao carrinho
O CPDB é ativado pela tripsina. O CPDB é altamente específico para lisina e arginina, mas mostra preferência pela arginina (Tan e Eaton 1995). Também pode atuar (em uma taxa mais lenta) sobre valina, leucina, isoleucina, asparagina, glicina e glutamina (Villegas et al. 1995, Nishihira et al. 1995). As diferenças nas especificidades entre carboxipeptidase A (CPDA) e CPDB podem ser atribuídas aos resíduos Ser205, Gly241 e Asp253 em CPDB em comparação com Gly207, Ile243 e Ile255 em CPDA (Coll et al. 1991).
Características moleculares:
Clauser et ai. estudaram o gene da preprocarboxipeptidase B de rato e descobriram que ele é organizado de maneira muito semelhante ao gene CPB1 bovino (Clauser et al. 1988). O gene CPB1 é conservado em muitos eucariotos e foi estudado em humanos, chimpanzés, cães, camundongos, ratos, galinhas, peixes-zebra e moscas da fruta (Avilés e Vendrell 2004). A forma madura de CPDB de rato é homóloga à CPDB bovina (77% idêntica), e os aminoácidos envolvidos na catálise ou na ligação do ligante não apresentam variação. A região de codificação da pré-procarboxipeptidase B consiste em 11 exons (Clauser et al. 1988). Comparações de CPDB de rato, CPDA de rato e CPDA2 de rato genes mostraram que o número, posição e composição da sequência dos exons são conservados, apesar das grandes diferenças nas sequências intervenientes (Gardell et al. 1988, e Clauser et al. 1988). Através do sequenciamento de cDNA e mRNA, o mRNA de CPDB foi determinado como sendo 1385 nucleotídeos, excluindo a cauda poli(A). O mRNA de CPDB de rato é 100 nucleotídeos mais longo que o mRNA de CPDA. Esta diferença é principalmente devido a uma região 3′ não traduzida (UTR) maior no mRNA de CPDB (Han et al. 1986).
Composição:
A principal forma de CPDB é encontrada no estado monomérico. CPDB contém 1 átomo de zinco por mol de proteína. Os resíduos que coordenam o resíduo de zinco são conservados e incluem duas histidinas, um ácido glutâmico e uma água (Avilés e Vendrell 2004).
-
R$12.411,28Adicionar ao carrinho
O CPDB é ativado pela tripsina. O CPDB é altamente específico para lisina e arginina, mas mostra preferência pela arginina (Tan e Eaton 1995). Também pode atuar (em uma taxa mais lenta) sobre valina, leucina, isoleucina, asparagina, glicina e glutamina (Villegas et al. 1995, Nishihira et al. 1995). As diferenças nas especificidades entre carboxipeptidase A (CPDA) e CPDB podem ser atribuídas aos resíduos Ser205, Gly241 e Asp253 em CPDB em comparação com Gly207, Ile243 e Ile255 em CPDA (Coll et al. 1991).
Características moleculares:
Clauser et ai. estudaram o gene da preprocarboxipeptidase B de rato e descobriram que ele é organizado de maneira muito semelhante ao gene CPB1 bovino (Clauser et al. 1988). O gene CPB1 é conservado em muitos eucariotos e foi estudado em humanos, chimpanzés, cães, camundongos, ratos, galinhas, peixes-zebra e moscas da fruta (Avilés e Vendrell 2004). A forma madura de CPDB de rato é homóloga à CPDB bovina (77% idêntica), e os aminoácidos envolvidos na catálise ou na ligação do ligante não apresentam variação. A região de codificação da pré-procarboxipeptidase B consiste em 11 exons (Clauser et al. 1988). Comparações de CPDB de rato, CPDA de rato e CPDA2 de rato genes mostraram que o número, posição e composição da sequência dos exons são conservados, apesar das grandes diferenças nas sequências intervenientes (Gardell et al. 1988, e Clauser et al. 1988). Através do sequenciamento de cDNA e mRNA, o mRNA de CPDB foi determinado como sendo 1385 nucleotídeos, excluindo a cauda poli(A). O mRNA de CPDB de rato é 100 nucleotídeos mais longo que o mRNA de CPDA. Esta diferença é principalmente devido a uma região 3′ não traduzida (UTR) maior no mRNA de CPDB (Han et al. 1986).
Composição:
A principal forma de CPDB é encontrada no estado monomérico. CPDB contém 1 átomo de zinco por mol de proteína. Os resíduos que coordenam o resíduo de zinco são conservados e incluem duas histidinas, um ácido glutâmico e uma água (Avilés e Vendrell 2004).
-
R$1.727,52Adicionar ao carrinho
Celulase refere-se a uma família de enzimas que atuam em conjunto para hidrolisar a celulose. Trichoderma reesei tem um complexo enzimático de celulase extensivamente estudado. Este complexo converte celuloses cristalinas, amorfas e quimicamente derivadas quantitativamente em glicose.
Definição da Unidade: Uma Unidade libera 0,01 miligramas de glicose por hora da celulose microcristalina a 37°C, pH 5,0.
-
R$553,48Adicionar ao carrinho
A quimotripsina é ativada através da clivagem da ligação entre arginina e isoleucina (R15 e I16) pela tripsina, causando modificações estruturais e formação do sítio de ligação do substrato (Sears 2010). A quimotripsina difere da tripsina porque a tripsina cliva os peptídeos em resíduos de arginina e lisina, enquanto a quimotripsina prefere grandes resíduos hidrofóbicos (Hedstrom et al. 1992). A quimotripsina catalisa preferencialmente a hidrólise de ligações peptídicas envolvendo L-isômeros de tirosina, fenilalanina e triptofano. Também atua prontamente sobre amidas e ésteres de aminoácidos suscetíveis. A especificidade da quimotripsina para grandes resíduos hidrofóbicos pode ser explicada por uma ligação hidrofóbica S1 formada pelos resíduos 189 a 195, 214 a 220 e 225 a 228 (Cohen et al. 1981).
Embora a estrutura do sítio S1 da tripsina e da quimotripsina mostre apenas uma diferença (na posição 189), a mutagênese sítio-dirigida da tripsina e da quimotripsina não conseguiu trocar especificidades, sugerindo que o mecanismo pelo qual a tripsina e a quimotripsina atingem a catálise específica do substrato não é totalmente compreendido. Steitz e outros 1969 e Gráf e outros 1988).
Características moleculares:
Quimotripsina A e B compartilham 80% de identidade de sequência (Hartley 1964, Meloun et al. 1966, Smillie et al. 1968 e Gráf et al. 2004). Os aminoácidos da tríade catalítica (H57, D102 e S195) são altamente conservados nas sequências das peptidases da família S1 (Gráf et al. 2004). A serina na posição 214 também é altamente conservada na família e foi proposta como o quarto membro da tríade catalítica (Ohara et al. 1989, e McGrath et al. 1992).
Composição:
Os três resíduos de aminoácidos da tríade catalítica (H57, D102 e S195) são essenciais para a clivagem da ligação peptídica e são estabilizados por ligações de hidrogênio (Sears 2010 e Gráf et al. 2004). G193 e S195 formam o buraco oxiânion e interagem com o grupo carbonila da ligação peptídica cissil, orientando-o para formar o intermediário tetraédrico (Rühlmann et al. 1973, Huber e Bode 1978, e Gráf et al. 2004).
-
R$4.528,44Adicionar ao carrinho
As colagenases AFA, AFB e AFC são derivadas de culturas cultivadas em meio completamente desprovido de componentes de origem animal e projetadas para aplicações de bioprocessamento onde a introdução de potenciais patógenos derivados de animais deve ser evitada. Os níveis de proteases secundárias são semelhantes aos tipos 1 e 2 de colagenase.
• CLSAFA é o grau AFA original projetado para ter colagenase e proteases secundárias semelhantes às colagenases dos Tipos 1 e 2.
• CLSAFB contém maiores atividades de colagenase e caseinase do que CLSAFA.
• CLSAFC tem atividade tríptica especialmente baixa semelhante à colagenase tipo 4.A Worthington também oferece preparações filtradas de 0,22 mícron de cada tipo em forma pré-embalada de 50 mg/frasco para reconstituição direta e uso em todos os procedimentos de isolamento.
-
R$922,46Adicionar ao carrinho
As colagenases AFA, AFB e AFC são derivadas de culturas cultivadas em meio completamente desprovido de componentes de origem animal e projetadas para aplicações de bioprocessamento onde a introdução de potenciais patógenos derivados de animais deve ser evitada. Os níveis de proteases secundárias são semelhantes aos tipos 1 e 2 de colagenase.
• CLSAFA é o grau AFA original projetado para ter colagenase e proteases secundárias semelhantes às colagenases dos Tipos 1 e 2.
• CLSAFB contém maiores atividades de colagenase e caseinase do que CLSAFA.
• CLSAFC tem atividade tríptica especialmente baixa semelhante à colagenase tipo 4.A Worthington também oferece preparações filtradas de 0,22 mícron de cada tipo em forma pré-embalada de 50 mg/frasco para reconstituição direta e uso em todos os procedimentos de isolamento.
-
R$922,46Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$922,46Adicionar ao carrinho
As colagenases AFA, AFB e AFC são derivadas de culturas cultivadas em meio completamente desprovido de componentes de origem animal e projetadas para aplicações de bioprocessamento onde a introdução de potenciais patógenos derivados de animais deve ser evitada. Os níveis de proteases secundárias são semelhantes aos tipos 1 e 2 de colagenase.
• CLSAFA é o grau AFA original projetado para ter colagenase e proteases secundárias semelhantes às colagenases dos Tipos 1 e 2.
• CLSAFB contém maiores atividades de colagenase e caseinase do que CLSAFA.
• CLSAFC tem atividade tríptica especialmente baixa semelhante à colagenase tipo 4.A Worthington também oferece preparações filtradas de 0,22 mícron de cada tipo em forma pré-embalada de 50 mg/frasco para reconstituição direta e uso em todos os procedimentos de isolamento.
-
R$15.765,68Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$3.773,70Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$737,97Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$15.765,68Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5
-
R$15.765,68Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$1.257,90Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5
-
R$1.257,90Adicionar ao carrinho
As colagenases AFA, AFB e AFC são derivadas de culturas cultivadas em meio completamente desprovido de componentes de origem animal e projetadas para aplicações de bioprocessamento onde a introdução de potenciais patógenos derivados de animais deve ser evitada. Os níveis de proteases secundárias são semelhantes aos tipos 1 e 2 de colagenase.
• CLSAFA é o grau AFA original projetado para ter colagenase e proteases secundárias semelhantes às colagenases dos Tipos 1 e 2.
• CLSAFB contém maiores atividades de colagenase e caseinase do que CLSAFA.
• CLSAFC tem atividade tríptica especialmente baixa semelhante à colagenase tipo 4.• A Worthington também oferece preparações filtradas de 0,22 mícron de cada tipo em forma pré-embalada de 50 mg/frasco para reconstituição direta e uso em todos os procedimentos de isolamento.
-
R$1.257,90Adicionar ao carrinho
Colagenase Animal Free/AF (Código: CLSAFC) que é filtrada através de uma membrana de 0,22 mícron e liofilizada em frascos.
Fonte: Clostridium histolyticum
Atividade: ≥200 unidades por mg de peso seco.
Código: CLSAFCS. -
R$3.773,70Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromol de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$737,97Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromol de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$15.765,68Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromol de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$3.773,70Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromol de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$737,97Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromol de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5.
-
R$3.773,70Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5
-
R$737,97Adicionar ao carrinho
As colagenases brutas são amplamente utilizadas em procedimentos de isolamento de células primárias enzimáticas e dissociação de tecidos. A maioria dos pesquisadores emprega preparações de colagenase bruta como os Tipos 1, 2, 3 e 4 ou colagenase purificada cromatograficamente (Código: CLSPA); este último geralmente combinado com enzimas secundárias como elastase, hialuronidase, etc. Para melhores resultados, a mistura precisa de atividades proteolíticas deve ser adaptada ao tecido a ser dissociado. As correlações entre o tipo e a eficácia com diferentes tecidos têm sido boas, mas não perfeitas, e podem depender parcialmente dos parâmetros de uso e objetivos, bem como das variações de lote para lote. Para obter mais informações, consulte as informações do Programa de Amostragem de Colagenase . Worthington também publica um Guia de Dissociação de Tecidos que fornece informações adicionais sobre as enzimas usadas para essas aplicações e referências específicas para vários tipos de células e tecidos.
Definição da unidade : Uma unidade libera um micromole de equivalentes de L-leucina do colágeno em 5 horas a 37°C, pH 7,5
-
R$1.928,78Adicionar ao carrinho
A desoxirribonuclease pancreática bovina é uma endonuclease que divide as ligações fosfodiéster, preferencialmente adjacentes a um nucleotídeo de pirimidina produzindo polinucleotídeos com grupo hidroxila livre na posição 3′ e grupo fosfato na posição 5′. O comprimento médio da cadeia de uma digestão limite é um tetranucleotídeo.
Definição da unidade: 1 unidade causa um aumento na absorbância em 260nm de 0,001 por minuto por ml a 25°C quando atua sobre DNA altamente polimerizado em pH 5,0. Nota: As unidades Kunitz relatadas por outros fornecedores podem ser 2 a 4 vezes maiores do que as unidades Kunitz medidas em Worthington. Conforme medido em Worthington, uma unidade Kunitz digere 1 µg de DNA lambda em 10 minutos a 37°C em 50 mM de Tris, 1 mM de Mg2+, 1 mM de Ca2+, pH 7,8 em uma reação de 50 µl. A correlação de unidades de digestão com unidades Kunitz é diferente para outros sistemas de DNA e tampão.
-
R$1.761,06Adicionar ao carrinho
A desoxirribonuclease pancreática bovina é uma endonuclease que divide as ligações fosfodiéster, preferencialmente adjacentes a um nucleotídeo de pirimidina produzindo polinucleotídeos com grupo hidroxila livre na posição 3′ e grupo fosfato na posição 5′. O comprimento médio da cadeia de uma digestão limite é um tetranucleotídeo.
Definição da unidade: 1 unidade causa um aumento na absorbância em 260nm de 0,001 por minuto por ml a 25°C quando atua sobre DNA altamente polimerizado em pH 5,0. Nota: As unidades Kunitz relatadas por outros fornecedores podem ser 2 a 4 vezes maiores do que as unidades Kunitz medidas em Worthington. Conforme medido em Worthington, uma unidade Kunitz digere 1 µg de DNA lambda em 10 minutos a 37°C em 50 mM de Tris, 1 mM de Mg2+, 1 mM de Ca2+, pH 7,8 em uma reação de 50 µl. A correlação de unidades de digestão com unidades Kunitz é diferente para outros sistemas de DNA e tampão.
-
R$805,06Adicionar ao carrinho
A desoxirribonuclease pancreática bovina é uma endonuclease que divide as ligações fosfodiéster, preferencialmente adjacentes a um nucleotídeo de pirimidina produzindo polinucleotídeos com grupo hidroxila livre na posição 3′ e grupo fosfato na posição 5′. O comprimento médio da cadeia de uma digestão limite é um tetranucleotídeo.
Definição da unidade: 1 unidade causa um aumento na absorbância em 260nm de 0,001 por minuto por ml a 25°C quando atua sobre DNA altamente polimerizado em pH 5,0. Nota: As unidades Kunitz relatadas por outros fornecedores podem ser 2 a 4 vezes maiores do que as unidades Kunitz medidas em Worthington. Conforme medido em Worthington, uma unidade Kunitz digere 1 µg de DNA lambda em 10 minutos a 37°C em 50 mM de Tris, 1 mM de Mg2+, 1 mM de Ca2+, pH 7,8 em uma reação de 50 µl. A correlação de unidades de digestão com unidades Kunitz é diferente para outros sistemas de DNA e tampão.
-
R$3.522,12Adicionar ao carrinho
Desoxirribonuclease I pancreática bovina produzida de forma recombinante em levedura, Pichia pastoris, para diminuir os níveis de RNase contaminante e eliminar patógenos potenciais associados a materiais de origem animal.
O pâncreas bovino é uma rica fonte de RNase A que é frequentemente encontrada em muitas preparações comerciais de DNase. A produção de DNase I por meios recombinantes em um organismo com níveis muito mais baixos de RNase endógena facilita muito a purificação de uma enzima com níveis indetectáveis de RNase. Os processos envolvidos na produção e isolamento de DNase I recombinante são completamente desprovidos de componentes de origem animal, o que elimina a possibilidade de introdução de patógenos derivados de animais em procedimentos de bioprocessamento.
A DNase I recombinante é adequada para aplicações como:
- Remoção de DNA genômico de preparações de RNA antes da RT-PCR;
- Degradação de modelos de DNA após reações de transcrição;
- Remoção de DNA indesejado de amostras antes do Northern blotting;
- Remoção de DNA durante procedimentos biofarmacêuticos e de bioprocessamento.
-
R$2.884,78Adicionar ao carrinho
A endoproteinase-Lys-C é uma serina endoproteinase que cliva especificamente as ligações peptídicas no lado carboxila da lisina. Ele tem um peso molecular de 30.000 daltons e é usado na faixa de pH ideal de 7,0-9,0. Lys-C é inibida por diisopropilfluorofosfato, TLCK, Aprotinina e Leupeptina.
-
R$1.106,95Adicionar ao carrinho
As β-Galactosidases estão amplamente difundidas, em microrganismos, animais e plantas. O da cepa K12 de Escherichia coli foi particularmente estudado no laboratório de Anfinsen em conexão com experimentos genéticos sobre regulação gênica da síntese de proteínas. Craven, Steers e Anfinsen 1965). A enzima foi revisada em detalhes por Wallenfels e Weil (1972). A lactase pode ser usada como reagente para determinar a lactose no sangue e outros fluidos biológicos.
Outra aplicação importante é no processamento de alimentos. De especial interesse é seu uso no tratamento do leite para atender às necessidades da grande porcentagem da população mundial que sofre de intolerância à lactose. As aplicações industriais exigem a imobilização da enzima sobre a qual uma investigação considerável foi relatada (Byrne e Johnson 1975; Narinesingh et al . 1975; Paine e Carbonell 1975; Faulsitch et al . 1974; Bunting e Laidler 1972, Lilly 1971, Khare e Gupta 1988, e Park e Hoffman 1990).
-
R$519,93Adicionar ao carrinho
A lisozima hidrolisa preferencialmente as ligações β-1,4 glicosídicas entre o ácido N-acetilmurâmico e a N-acetilglucosamina que ocorrem na estrutura da parede celular do mucopeptídeo de certos microrganismos, como Micrococcus lysodeikticus (Código do produto: ML). Uma atividade ligeiramente mais limitada é exibida em relação aos oligômeros de quitina. Tem um peso molecular de 14.388 daltons. O pH ótimo é 9,2. A lisozima é inibida por agentes tensoativos como dodecil sulfato, álcool e ácidos graxos. Derivados de imidazol e indol formam complexos de transferência de carga inibitória.
Estabilidade/Armazenamento : Estável por 3-5 anos a 2-8°C. Soluções em pH 4-5 são estáveis por várias semanas sob refrigeração e por dias em temperatura ambiente. Armazenar a 2-8°C.
Nota técnica : Devido a diferenças de ensaio, 8.000u/mg pelo ensaio de Worthington é equivalente a 50.000u/mg reivindicado por outros fornecedores.
Definição de Unidade : Uma Unidade é igual a uma diminuição na turbidez de 0,001 por minuto a 450 nm a pH 7,0 e 25°C, usando uma suspensão de 0,3 mg/ml de células Micrococcus lysodeikticus (código de produto WBC ML) como substrato.
-
R$2.649,98Adicionar ao carrinho
A lisozima hidrolisa preferencialmente as ligações β-1,4 glicosídicas entre o ácido N-acetilmurâmico e a N-acetilglucosamina que ocorrem na estrutura da parede celular do mucopeptídeo de certos microrganismos, como Micrococcus lysodeikticus (Código do produto: ML). Uma atividade ligeiramente mais limitada é exibida em relação aos oligômeros de quitina. Tem um peso molecular de 14.388 daltons. O pH ótimo é 9,2. A lisozima é inibida por agentes tensoativos como dodecil sulfato, álcool e ácidos graxos. Derivados de imidazol e indol formam complexos de transferência de carga inibitória.
Estabilidade/Armazenamento : Estável por 3-5 anos a 2-8°C. Soluções em pH 4-5 são estáveis por várias semanas sob refrigeração e por dias em temperatura ambiente. Armazenar a 2-8°C.
Nota técnica : Devido a diferenças de ensaio, 8.000u/mg pelo ensaio de Worthington é equivalente a 50.000u/mg reivindicado por outros fornecedores.
Definição de Unidade : Uma Unidade é igual a uma diminuição na turbidez de 0,001 por minuto a 450 nm a pH 7,0 e 25°C, usando uma suspensão de 0,3 mg/ml de células Micrococcus lysodeikticus (código de produto WBC ML) como substrato.
-
R$637,34Adicionar ao carrinho
A lisozima hidrolisa preferencialmente as ligações β-1,4 glicosídicas entre o ácido N-acetilmurâmico e a N-acetilglucosamina que ocorrem na estrutura da parede celular do mucopeptídeo de certos microrganismos, como Micrococcus lysodeikticus (Código do produto: ML). Uma atividade ligeiramente mais limitada é exibida em relação aos oligômeros de quitina. Tem um peso molecular de 14.388 daltons. O pH ótimo é 9,2. A lisozima é inibida por agentes tensoativos como dodecil sulfato, álcool e ácidos graxos. Derivados de imidazol e indol formam complexos de transferência de carga inibitória.
Estabilidade/Armazenamento : Estável por 3-5 anos a 2-8°C. Soluções em pH 4-5 são estáveis por várias semanas sob refrigeração e por dias em temperatura ambiente. Armazenar a 2-8°C.
Nota técnica : Devido a diferenças de ensaio, 8.000u/mg pelo ensaio de Worthington é equivalente a 50.000u/mg reivindicado por outros fornecedores.
Definição de Unidade : Uma Unidade é igual a uma diminuição na turbidez de 0,001 por minuto a 450 nm a pH 7,0 e 25°C, usando uma suspensão de 0,3 mg/ml de células Micrococcus lysodeikticus (código de produto WBC ML) como substrato.
-
R$1.677,20Adicionar ao carrinho
A lisozima hidrolisa preferencialmente as ligações β-1,4 glicosídicas entre o ácido N-acetilmurâmico e a N-acetilglucosamina que ocorrem na estrutura da parede celular do mucopeptídeo de certos microrganismos, como Micrococcus lysodeikticus (Código do produto: ML). Uma atividade ligeiramente mais limitada é exibida em relação aos oligômeros de quitina. Tem um peso molecular de 14.388 daltons. O pH ótimo é 9,2. A lisozima é inibida por agentes tensoativos como dodecil sulfato, álcool e ácidos graxos. Derivados de imidazol e indol formam complexos de transferência de carga inibitória.
Estabilidade/Armazenamento : Estável por 3-5 anos a 2-8°C. Soluções em pH 4-5 são estáveis por várias semanas sob refrigeração e por dias em temperatura ambiente. Armazenar a 2-8°C.
Nota técnica : Devido a diferenças de ensaio, 8.000u/mg pelo ensaio de Worthington é equivalente a 50.000u/mg reivindicado por outros fornecedores.
Definição de Unidade : Uma Unidade é igual a uma diminuição na turbidez de 0,001 por minuto a 450 nm a pH 7,0 e 25°C, usando uma suspensão de 0,3 mg/ml de células Micrococcus lysodeikticus (código de produto WBC ML) como substrato.
-
R$821,83Adicionar ao carrinho
A ovalbumina é uma glicoproteína com peso molecular de 45 kDa. A molécula consiste em um polipeptídeo com até dois grupos fosfato por mol e uma cadeia lateral de resíduos de manose e glucosamina.
-
R$5.199,32Adicionar ao carrinho
Conjunto de cinco frascos de uso único de papaína e cinco frascos de uso único de DNase, 100 ml de solução salina balanceada de Earle (EBSS) e um frasco de inibidor para uso no método de dissociação tecidual de Huettner, JE, e Baughman, RW: J. Neuroscience, 6, 3044 (1986).
-
R$1.576,57Adicionar ao carrinho
A papaína é uma protease sulfidrila do látex de Carica papaya. Tem um peso molecular de 23 kDa e uma faixa de pH ideal de 6,0-7,0. A ação da papaína no éster metílico da leucina produz um peptídeo polileucina insolúvel. A papaína quebra a matriz intercelular da cartilagem. A papaína é ativada por cisteína, sulfeto e sulfito. Os agentes estabilizantes são EDTA, cisteína e dimercaptoetanol.
Estabilidade/Armazenamento: Estável por 6-12 meses a 2-8°C. Não congele suspensões aquosas.
Notas técnicas: As preparações de papaína devem ser incubadas na solução de ativação antes do uso para garantir atividade completa. As aplicações incluem fragmentação de anticorpos e isolamento de células primárias/neurais.
Definição da Unidade: Uma Unidade hidrolisa um micromole de éster etílico de benzoil-L-arginina por minuto a 25°C, pH 6,2, após ativação em uma solução contendo 1,1 mM de EDTA, 0,067 mM de mercaptoetanol e 5,5 mM de cisteína-HCl por 30 minutos.
-
R$1.811,38Adicionar ao carrinho
A pepsina tem ampla especificidade com preferência por peptídeos contendo ligações com L-aminoácidos aromáticos ou carboxílicos. Ele cliva preferencialmente C-terminal para Phe e Leu e, em menor grau, ligações Glu. A enzima não cliva em Val, Ala ou Gly.
Características moleculares:
A sequência de aminoácidos da pepsina suína foi determinada por Tang et al. (1973) e Moravek e Kostka (1974), e posteriormente confirmado por análise de cDNA por Tsukagoshi et al. (1988) e Lin et al. (1989).
O gene do pepsinogênio A ( PGA ) é dividido entre nove éxons que abrangem aproximadamente 9,4 kb de DNA genômico (Sogawa 1983).
Existem várias versões dos genes PGA encontrados em populações humanas e de chimpanzés, mas as atividades desses vários produtos gênicos são indistinguíveis (Taggart 1985 e Zelle 1988). Em contraste, análises de Southern blot de uma amostragem de porcos sugerem que há apenas um único gene PGA encontrado em todos os porcos (Evers 1988).
A produção de PGA é controlada principalmente ao nível da transcrição (Sogawa et al. 1981 e Ichinose et al. 1988). Em humanos e porcos, verificou-se que o gene PGA está sob controle transcricional específico do tecido, com mRNA detectado apenas na mucosa fúndica gástrica (Ichinose 1991 e Meijerink et al. 1993). A transcrição do gene PGA é regulada por proteínas ativadoras da transcrição que atuam em 3 regiões principais nas regiões promotoras e de iniciação do gene PGA (Meijerink et al. 1993).
Existem quatro proteínas pepsinas relatadas: pepsina A, pepsina B (parapepsina I), pepsina C (gastricsina) e pepsina D (uma versão não fosforilada da pepsina A) (Lee e Ryle 1967). A pepsina A é a protease gástrica predominante; pequenas quantidades das outras pepsinas foram detectadas. As pepsinas B e C compartilham um maior grau de homologia entre si. No cão, B e C compartilham 89% de identidade, A e B compartilham 44% de identidade e A e C compartilham 45% de identidade (calculado com base em Thompson et al. 1994).
Composição:
A pepsina é uma proteína monomérica, de dois domínios, principalmente beta, com alta porcentagem de resíduos ácidos. A pepsina suína tem 4 resíduos básicos e 42 resíduos ácidos e é O -fosforilada em S68 (Tang et al. 1973). Para que a proteína seja ativa, um dos dois resíduos de aspartato no sítio catalítico deve ser protonado e o outro desprotonado. Isso ocorre entre pH 1 e 5, e acima de pH 7 a pepsina é irreversivelmente desnaturada.
-
R$7.966,70Adicionar ao carrinho
A fosfatase alcalina é um termo amplo associado a fosfomonoesterases não específicas com um pH alcalino ótimo.
Definições de fonte/unidade :
CAP: Intestino de vitela. Uma Unidade Worthington hidrolisa 1umol de fosfato de p-nitrofenol por minuto a 37°C, pH 9,8.BAPF, BAPC, BAPSF: E. coli . Uma Unidade hidrolisa 1µmol de fosfato de p-nitrofenol por minuto a 25°C, pH 8,0.
PC: Intestino de Galinha. Uma unidade hidrolisa 1umol de fosfato de o-carboxifenol por minuto a 25°C, pH 8,8.
Notas técnicas : A fosfatase alcalina de intestino de frango Worthington (Código: PC) é a preparação utilizada na medição de fosfato de dexametasona da NF/USP.
-
R$2.146,82Adicionar ao carrinho
A fosfatase alcalina é um termo amplo associado a fosfomonoesterases não específicas com um pH alcalino ótimo.
Definições de fonte/unidade :
CAP: Intestino de vitela. Uma Unidade Worthington hidrolisa 1umol de fosfato de p-nitrofenol por minuto a 37°C, pH 9,8.BAPF, BAPC, BAPSF: E. coli . Uma Unidade hidrolisa 1µmol de fosfato de p-nitrofenol por minuto a 25°C, pH 8,0.
PC: Intestino de Galinha. Uma unidade hidrolisa 1umol de fosfato de o-carboxifenol por minuto a 25°C, pH 8,8.
Notas técnicas : A fosfatase alcalina de intestino de frango Worthington (Código: PC) é a preparação utilizada na medição de fosfato de dexametasona da NF/USP.
-
R$1.324,99Adicionar ao carrinho
A fosfolipase A2 é um membro da classe de enzimas dependentes de cálcio estáveis ao calor que catalisam a hidrólise da ligação 2-acil de 3-n-fosfoglicerídeos. A enzima tem um peso molecular de 30.000 daltons. A fosfolipase A2 é ativada pelo Ca2+. É inibido por íons de zinco, bário e manganês. Os valores de atividade para preparações de fosfolipase A que são derivadas de procedimentos de ensaio titrimétrico podem ser bastante dependentes da fonte e tipo de lecitina, sua preparação como uma emulsão de substrato, outros componentes da mistura de reação e o método e instrumentação usados.
Definição da Unidade: Uma Unidade libera um micromole de ácido da lecitina de soja por minuto a 25°C, pH 8,9.
-
R$2.113,27Adicionar ao carrinho
Monofenol, Dihidroxifenilalanina: O2 Oxidorredutase
TirosinaseReação enzimática (a imagem será aberta em uma nova janela)
A polifenol oxidase (tirosinase) (TY) é uma oxidase bifuncional contendo cobre com atividade de catecolase e cresolase (Malmström e Rydén 1968):

Jolley et ai . (1974) referem-se a ele como um oxigênio e 4 fenol oxidase de transferência de elétrons. É responsável por reações de escurecimento em toda a escala filogenética.
Embora uma tirosinase de Neurospora crassa tenha sido purificada (Fling et ai . 1963), a maior parte do trabalho foi feito com a enzima do cogumelo, embora os rendimentos e a consistência sejam fracos; sua multiplicidade foi mostrada por Smith e Krueger (1962). Bouchiloux et ai . (1963) obtiveram quatro enzimas. Ver revisão de Nelson e Mason (1970).
Peso molecular : 128.000 (Duckworth e Coleman 1970).
Composição : A enzima é um tetrâmero contendo quatro gramas de átomos de cobre por molécula (Jolley et al . 1974), e dois sítios de ligação para compostos aromáticos incluindo substratos fenólicos. Há também um sítio de ligação distintamente diferente para o oxigênio, o sítio do cobre (Duckworth e Coleman 1970). O cobre está provavelmente no estado cuproso; a inativação da enzima está associada ao aumento de Cu 2+ . (Kertész et ai . 1972). A composição de aminoácidos foi determinada. Extensos estudos estruturais foram relatados por Jolley et al . (1969); e Duckworth e Coleman (1970). Ver também Jolley et ai . (1972, 1973 e 1974).
-
R$1.324,99Adicionar ao carrinho
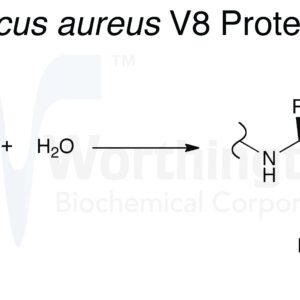
A protease S. aureus, V8 (endoproteinase-Glu-C) cliva especificamente as ligações peptídicas no lado COOH-terminal dos ácidos aspártico ou glutâmico (Drapeau et ai . 1972). Houmard e Drapeau (1972) relatam que na presença de tampões de amônio a especificidade da enzima pode ser limitada a ligações glutamoil. A sua especificidade bastante única, que pode ser considerada oposta à da tripsina, torna-a uma ferramenta útil para a química de proteínas e estudos de mapeamento de péptidos (Cleveland et ai . 1977) e (Hall et ai . 1978).
Peso molecular : 27.000 (Drapeau 1978).
Coeficiente de extinção :
 = 4,26 (Houmard 1976).
= 4,26 (Houmard 1976).pH ótimo : 4,0 e 7,8 com substrato de hemoglobina. (Drapeau et ai . 1972).
Inibidores : fluorofosfato de diisopropilo (DFP) e aniões monovalentes tais como F- , Cl- , Br- , CH3COO- e NO3- ( Houmard 1976) .
-
R$2.683,52Adicionar ao carrinho
O inibidor de tripsina de soja (SBTI) cristalizado pela primeira vez por Kunitz (1945) é um dos vários inibidores encontrados na soja. (Fratalli 1969; Millar et ai . 1969; Fratalli e Steiner 1968; Birk et ai . 1967). A preparação mais conhecida é a de Kunitz. Steiner e Fratalli (1969) revisaram os inibidores de Kunitz e Bowman-Birk. Uma proteína (ou polipeptídeo) inibidor de proteinase provavelmente possui ligações peptídicas compatíveis com o sítio reativo da protease. Finkenstadt e Laskowski (1965 e 1967) e Ozawa e Laskowski (1966) indicam que uma única ligação Arg-Ile é clivada pela tripsina; um complexo bimolecular covalente de inibidor e resultados de tripsina. Na dissociação aparece o inibidor virgem ou modificado; ver Hixson e Laskowski (1970a), Isheda et al. (1970) e Niekamp et ai . (1969).
Peso molecular : 21.500 ± 800 (Wu e Scheraga 1972a).
-
R$2.683,52Adicionar ao carrinho
A tripsina é uma serina protease pancreática com especificidade de substrato baseada em cadeias laterais de lisina e arginina carregadas positivamente. É derivado de um zimogênio precursor inativo de 34 kDa, tripsinogênio, após remoção enzimática de uma sequência líder de 6 aminoácidos N-terminal resultando na molécula de tripsina de 23,8 kDa. O pH ótimo é 8,0. A tripsina é inibida por compostos organofosforados, como diisopropilfluorofosfato e inibidores naturais do pâncreas. Soja, feijão de lima e clara de ovo também são fontes de inibidores naturais. A tripsina cliva as ligações amida e éster de Arg e Lys. A Tripsina de Grau de Sequenciamento de Worthington foi ainda purificada para remover vestígios de proteases contaminantes e produtos de autólise que poderiam interferir em experimentos de digestão de tripsina e exibe uma única banda no PAGE.
-
R$503,16Adicionar ao carrinho
A tripsina cliva peptídeos no lado C-terminal dos resíduos de aminoácidos de lisina e arginina. Se um resíduo de prolina estiver no lado carboxílico do local de clivagem, a clivagem não ocorrerá. Se um resíduo ácido estiver em ambos os lados do sítio de clivagem, a taxa de hidrólise mostrou ser mais lenta.
Composição:
O tripsinogênio pode ser ativado pela remoção de um hexapeptídeo terminal para produzir β-tripsina de cadeia simples. A autólise limitada subsequente produz outras formas ativas com duas ou mais cadeias peptídicas ligadas por pontes dissulfeto. As formas predominantes são a α-tripsina, com duas cadeias peptídicas e a β-, uma única cadeia. Diferentes atividades e estabilidade térmica são mostradas por α- e β-tripsina.
Outras características estruturais incluem alças de superfície nos aminoácidos 185-193, que influenciam a especificidade, apesar de não fazerem contato direto com o substrato. Um sítio de ligação de Ca2+ de alta afinidade é necessário para estabilidade e, quando não está presente, ocorre autólise. A alça de autólise (localizada nos aminoácidos 143-151) é muito flexível em tripsina e tripsinogênio. A clivagem na lisina produz a forma alfa que retém alguma atividade catalítica. A proteína tem seis ligações dissulfeto completamente conservadas (Halfon e Craik 1998).
Características moleculares:
O pâncreas bovino expressa duas formas de tripsina, a forma catiônica dominante e a aniônica menor. Essas sequências de proteínas compartilham 72% de identidade, enquanto suas regiões de codificação compartilham 78% de identidade.
Cada uma dessas proteínas é processada em formas alternativas. A tripsina catalítica contém uma “alça de autólise” flexível (resíduos G145-V157) (Schroeder e Shaw 1968, e Bartunik et al. 1989), e autólise da forma B-tripsina de cadeia única dominante em K148-S149 dentro desta alça para a formação de A-tripsina. Mais autólise em K193-D194 leva à formação de Psi-tripsina (Fehlhammer e Bode 1975).
As proteínas tripsina catiônica e aniônica são expressas como proenzimas de tripsinogênio, com um peptídeo sinal de 15 resíduos (M1-A15) e um propeptídeo de 8 resíduos (F16-K23). A dobra tridimensional de todas as tripsinas conhecidas é altamente conservada. Além disso, a tríade catalítica e as regiões que flanqueiam a tríade catalítica são altamente conservadas (Hartley 1970).
-
R$1.945,55Adicionar ao carrinho
A tripsina é uma serina protease pancreática com especificidade de substrato baseada em cadeias laterais de lisina e arginina carregadas positivamente. É derivado de um zimogênio precursor inativo de 34 kDa, o tripsinogênio, após a remoção enzimática de uma sequência líder de 6 aminoácidos N-terminal resultando na molécula de tripsina de 23,8 kDa. O pH ótimo é 8,0. A tripsina é inibida por compostos organofosforados, como diisopropilfluorofosfato e inibidores naturais do pâncreas. Soja, feijão de lima e clara de ovo também são fontes de inibidores naturais. A tripsina cliva as ligações amida e éster de Arg e Lys. A Tripsina de Grau de Sequenciamento de Worthington foi ainda purificada para remover vestígios de proteases contaminantes e produtos de autólise que poderiam interferir em experimentos de digestão de tripsina e exibe uma única banda no PAGE.
-
R$11.824,26Adicionar ao carrinho
A tripsina cliva peptídeos no lado C-terminal dos resíduos de aminoácidos de lisina e arginina. Se um resíduo de prolina estiver no lado carboxílico do local de clivagem, a clivagem não ocorrerá. Se um resíduo ácido estiver em ambos os lados do sítio de clivagem, a taxa de hidrólise mostrou ser mais lenta.
Composição:
O tripsinogênio pode ser ativado pela remoção de um hexapeptídeo terminal para produzir β-tripsina de cadeia simples. A autólise limitada subsequente produz outras formas ativas com duas ou mais cadeias peptídicas ligadas por pontes dissulfeto. As formas predominantes são a α-tripsina, com duas cadeias peptídicas e a β-, uma única cadeia. Diferentes atividades e estabilidade térmica são mostradas por α- e β-tripsina.
Outras características estruturais incluem alças de superfície nos aminoácidos 185-193, que influenciam a especificidade, apesar de não fazerem contato direto com o substrato. Um sítio de ligação de Ca2+ de alta afinidade é necessário para estabilidade e, quando não está presente, ocorre autólise. A alça de autólise (localizada nos aminoácidos 143-151) é muito flexível em tripsina e tripsinogênio. A clivagem na lisina produz a forma alfa que retém alguma atividade catalítica. A proteína tem seis ligações dissulfeto completamente conservadas (Halfon e Craik 1998).
Características moleculares:
O pâncreas bovino expressa duas formas de tripsina, a forma catiônica dominante e a aniônica menor. Essas sequências de proteínas compartilham 72% de identidade, enquanto suas regiões de codificação compartilham 78% de identidade.
Cada uma dessas proteínas é processada em formas alternativas. A tripsina catalítica contém uma “alça de autólise” flexível (resíduos G145-V157) (Schroeder e Shaw 1968, e Bartunik et al. 1989), e autólise da forma B-tripsina de cadeia única dominante em K148-S149 dentro desta alça para a formação de A-tripsina. Mais autólise em K193-D194 leva à formação de Psi-tripsina (Fehlhammer e Bode 1975).
As proteínas tripsina catiônica e aniônica são expressas como proenzimas de tripsinogênio, com um peptídeo sinal de 15 resíduos (M1-A15) e um propeptídeo de 8 resíduos (F16-K23). A dobra tridimensional de todas as tripsinas conhecidas é altamente conservada. Além disso, a tríade catalítica e as regiões que flanqueiam a tríade catalítica são altamente conservadas (Hartley 1970).